黏多糖贮积症 II 型(MPS II)是最常见的黏多糖贮积症之一,也是我国最常见的黏多糖贮积症类型。作为罕见病,MPS II的症状涉及多个系统。MPS II通常在2-4岁发病,儿科往往为首诊科室,如何识别MPS II并进行诊断呢?
MPS II也称为亨特综合征[1],该综合征由加拿大医师Charles Hunter于 1917 年在两个亲兄弟的临床观察后首次描述,后来被确认为 MPS II[1]。MPSⅡ型是一种罕见的遗传性疾病[1],是由于艾度糖醛酸‑2‑硫酸酯酶(见图1)(iduronate‑2‑sulfatase,IDS)基因变异引起IDS活性缺乏,使硫酸皮肤素(dermatansulphate,DS)和硫酸类肝素(heparansulphate,HS)不能被完全降解,从而贮积在各种组织、器官的溶酶体中,引起细胞和组织结构、功能改变,进而导致多器官、多系统结构和功能异常[2]。

MPS 是多器官疾病,可能会影响中枢和外周神经系统、心脏和肺、耳鼻喉和上呼吸道、眼睛、骨骼和关节[3]。出于临床目的,长期以来,亨特综合征一直被描述为呈现两种主要形式——轻型和重型[1],尽管重型通常更早出现,但两大类型之间的主要区别与神经系统受累的存在/不存在有关,主要表现为认知障碍和严重的行为问题。轻型可能表现为外周体征/症状进展缓慢,认知问题不存在或少见,并且没有行为困难[1]。重型患者表现为认知障碍和神经功能恶化导致成年前过早死亡,而轻型患者通常表现为进行性心肺功能不全、听力障碍和日常生活活动能力(ADL)逐渐下降[4]。
患者通常在出生时表现正常,在重型 MPS II 儿童中,面部特征粗糙、身材矮小、骨骼畸形、关节僵硬、心肺功能障碍和神经认知缺陷是典型的症状[5]。通常在 2-4 岁之间发病,伴有躯体症状,如慢性耳部感染、面部畸形、舌头和扁桃体肿大、肝/脾肿大和关节僵硬。认知发展和适应能力在 4 岁左右开始下降,并伴有严重的语言发育迟缓[5]。对于大多数患者而言,发育迟缓通常在 4-6 岁时,即认知能力下降的第2年逐渐出现[6],2-5 岁以下 MPS 患者的身高和体重均高于健康人,但随后几年其生长速度明显减慢[7]。听力损失开始于 2 岁左右,这会影响语言的发展。此外,多动、沮丧和冲动等异常行为开始于 4 岁左右[5](图2)。
MPS II 的临床诊断并不那么简单,因为它依赖于对通常不是 MPS II 特异性的体征和症状的识别,这些症状往往是与其他 LSD 或其他非溶酶体疾病共有的。然而,在大多数情况下,首先怀疑 MPS II 的原因是患者的典型面部特征,尤其是比较严重的患儿[1]。患儿通常表现出畸形的面部特征,往往有宽阔的鼻梁、大而圆的脸颊和厚厚的大嘴唇[8](图3)。
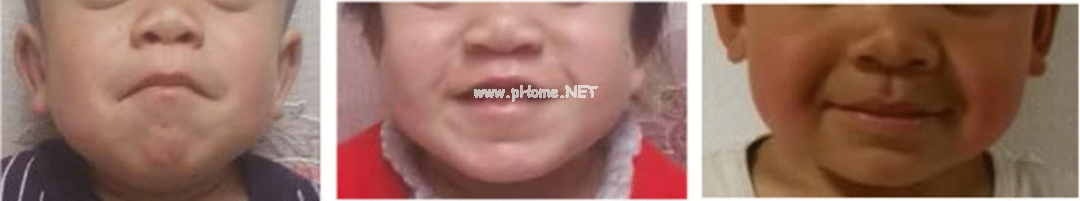
图3 患者畸形的面部特征——宽阔的鼻梁、大而圆的脸颊和厚厚的大嘴唇[8]
作为早期的诊断线索之一,患儿均有手指关节僵硬,往往与皮下组织糖胺聚糖沉积有关。关节进行性畸变,表现为肩关节上举受限、肘关节外展受限、膝关节屈曲、爪形手、脊柱侧凸、脊柱后凸等改变[2]。
此外,还有一个特征可以帮助MPS II的早期诊断,患儿出生时常有背部、臀部大片“蒙古斑”,随年龄增长“蒙古斑”颜色逐渐变淡[2]。
相比欧美国家,东亚国家及地区的MPS II患病率更高
作为 X 连锁性状遗传,MPS II 是最常见的 MPS 之一,多数欧洲国家活产新生儿患病率为0.13/10 万-0.71/10 万,如,挪威每 100,000 例活产婴儿患病率为 0.139,北爱尔兰每 100,000 例活产婴儿为 0.719。美国MPS II每 100,000 例活产婴儿为0.299、而在南美洲的巴西每 100,000例活产婴儿的病例数为0.379、澳大利亚0.31、加拿大为0.10。
在我国和其他东亚地区,MPSⅡ型是MPS中最常见的类型,约占所有MPS的一半[2]。韩国、日本、中国台湾每 100,000 例活产婴儿患病率分别为0.74、0.84及1.079。 图4为相关国家MPS II患病率。
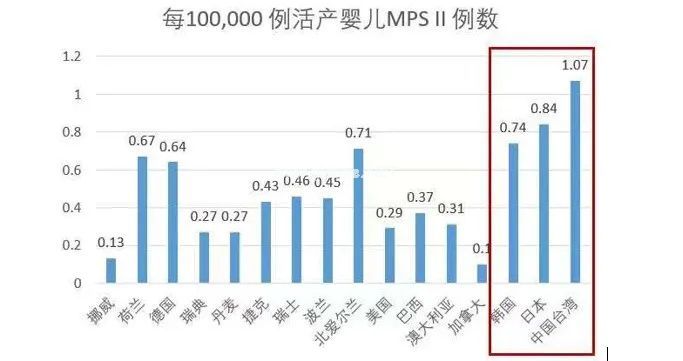
图4 MPS II患病率(每 100,000 例活产婴儿)
酶替代疗法(ERT)已被证明可减少尿糖胺聚糖(uGAG)和肝脏、脾脏体积,并改善MPS II患者的临床症状[10]。一项纳入126篇文章和27份文件的系统性综述(检索至2015年12月)显示:ERT治疗1年,可显著降低uGAG水平,从基线下降43%-80%,并且uGAG水平的降低与年龄和轻重型无关[11]。HOS研究结果显示,ERT可改善MPS II患者躯体症状体征[12]。此外,多项研究显示ERT可促进MPS II患者的生长发育[13,14]。台湾的研究发现MPS II 的 ERT 似乎对稳定或减缓心脏肥大的进展有效[15]。对确诊 MPS 或高度怀疑 MPS 的无症状婴儿进行强化的长期定期体检和实验室检查,可以提高及时实施 ERT 的能力。
目前ERT治疗MPS II 患者主要有两种药物,艾度硫酸酯酶和艾度硫酸酯酶β。这两种药物具有相同的氨基酸,但糖基化模式不同,因为它们是通过不同的细胞系中产生的,并且具有不同的制造工艺[16]。艾度硫酸酯酶β在吸收到患者的成纤维细胞中表现出更快的时间依赖性,并且,艾度硫酸酯酶β显示出比艾度硫酸酯酶更高的酶活性[16]。艾度硫酸酯酶β I/II期注册研究显示,艾度硫酸酯酶β各剂量组uGAG的降幅显著优于艾度硫酸酯酶;在24周时,与艾度硫酸酯酶对照组相比,艾度硫酸酯酶β 0.5 mg/kg和1.0 mg/kg 的6MWT变化百分比显著增加[17]。艾度硫酸酯酶β IIIb期研究对6岁以下的患儿进行了有效性评估,结果显示艾度硫酸酯酶β在6岁以下的儿童持续降低uGAG,在52周治疗中,入组时检测阴性的患者未产生新发抗体[18];与基线相比,身高显著增加5.6±2.4 cm(P=0.002),体重也显著增加2.83±1.3 kg(P=0.003)[18]。
MPS 新生儿筛查(NBS)的实施也是发现MPS II患儿的有效手段。其目标是早期发现、早期诊断、早期治疗,以有效防止不可逆临床表现的发展。自 2015 年以来,我国台湾已实施 MPS NBS计划,这些计划的有效性已得到证实。例如,诊断年龄已从 4.3 岁降低到 0.2 岁,从而有可能及时治疗并预防严重和不可逆的症状。MPS 传统上主要根据临床适应症进行诊断,后续治疗的结果普遍低于预期。然而,如果提高NBS方案对MPSs的筛查效率,进而提高MPSs的诊断准确性,对无症状、确诊和高度怀疑的MPS患者进行长期强化随访检查,在早期开始治疗,治疗效果是显著的[19]。
“黏宝宝诊断支持项目”助力MPS-II患儿早期筛查
随着中国目前首个且唯一的MPS II酶替代疗法药物海芮思(艾度硫酸酯酶β注射液)成功上市,北海康成制药有限公司(以下简称“北海康成”)长期以来不懈地推动开展MPS II医学教育。越来越多的医生开始了解并关注MPS II患者的诊治。
为了帮助更多MPS II高疑似患者实现早诊早治的目标,改善众多诊疗中心尚不具备酶检测条件的现状,北海康成援助中国初级卫生保健基金会发起的“黏宝宝诊断支持项目”(即艾度糖醛酸-2-硫酸酯酶的干血片检测项目)于2021年9月15日正式启动!该项目将为MPS II的高疑似患者免费提供酶学检测。
学小儿推拿,作人生赢家!赶快领取优惠券开始学习吧!

本文收录于合集:







